Yazan: Prof. Dr. Ömer Rıdvan Tarhan
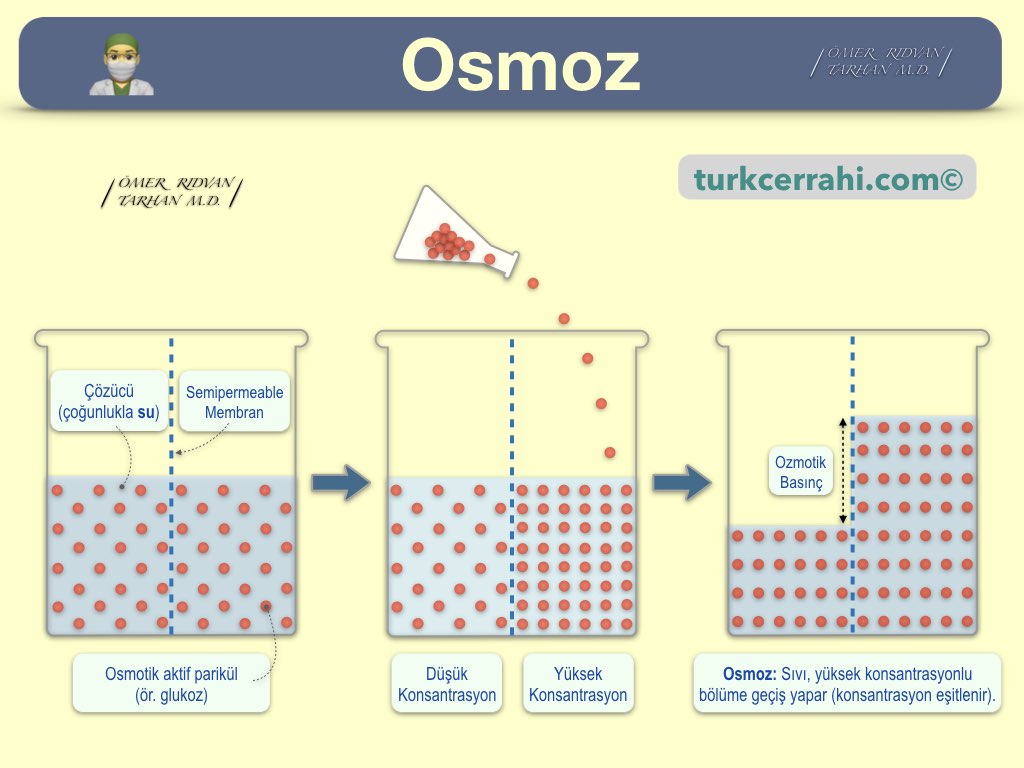
Osmoz, çözücünün (genellikle suyun) yarı geçirgen bir membran üzerinden, düşük çözünen konsantrasyonundan, yüksek konsantrasyona doğru difüzyonudur. Osmotik basınç, bu hareketi durdurmak için membrana uygulanması gereken basınçtır ve çözeltideki çözünen parçacıkların toplam konsantrasyonuyla doğru orantılıdır (osmolarite / osmolalite).
Tonisite ise bir çözeltinin, hücre membranı karşısında oluşturduğu osmotik etkiyi tanımlar; yani hücreyi şişirip şişirmeyeceği ya da büzüştürüp büzüştürmeyeceği ile ilgilidir.
Buna göre çözeltiler üç gruba ayrılır:
- İzotonik çözeltiler hücre hacminde değişiklik yapmaz (örneğin %0,9 NaCl, Ringer laktat),
- Hipotonik çözeltiler hücreye su girişine ve hücrenin şişmesine neden olur,
- Hipertonik çözeltiler ise hücreden su çıkışına ve hücrenin büzüşmesine neden olur.
Bu kavramlar, özellikle intravenöz sıvı tedavisi, dehidratasyon, hipernatremi, hiponatremi ve hücre ödemi gibi klinik durumların anlaşılmasında önem taşır.
1. Osmoz (Osmos)
Tanım: Osmoz, yarı geçirgen bir zar üzerinden, çözücü moleküllerinin (örn. suyun), çözünen madde konsantrasyonunun daha düşük olduğu bölgeden daha yüksek olduğu bölgeye doğru net geçişidir.
Anahtar Noktalar:
- Hareket eden sudur (çözücüdür); çözünen değil.
- Hareketin yönünü, konsantrasyonun yüksek olduğu tarafadır
- Hücre zarı yarı geçirgendir, suyun serbestçe geçişine izin verir, ancak çözünen maddelerin (elektrolitler, büyük moleküller) çoğu geçemez veya kısıtlı geçer.
Amaç: Konsantrasyon farkını azaltmak böylece her iki tarafın osmolaritesini eşitlemekdir.
2. Osmotik Basınç
Tanım: Osmotik basınç, osmotik hareketi durdurmak için gereken hidrostatik basınçtır.
Açıklama: Yarı geçirgen bir zarın iki tarafındaki konsantrasyon farkı ne kadar büyükse, suyu yoğun (konsantre) tarafa çekme "eğilimi (osmotik basınç)" o kadar büyük olur.
Klinik Önemi: Plazmanın osmotik basıncı, büyük oranda plazmadaki sodyum konsantrasyonu ([Na⁺]) tarafından belirlenir. Bu basınç, kılcal (kapiller) damarlarda sıvının damar içi (intravasküler) ve dışı (interstisyel-hücreler arası) kompartmanlar arasında dağılımını kontrol eden Starling Kuvvetleri'nin temel bileşenidir.
3. Tonisite (Tonicity)
Tanım: Tonisite, bir çözeltinin, hücre içine su girip çıkmasına neden olma yeteneğini ifade eden fonksiyonel bir kavramdır. Sadece hücre zarından geçemeyen partiküller tonisiteyi belirler.
Osmolarite ile Arasındaki Kritik Fark:
- Osmolarite sadece partikül sayısını ölçer (örn. üre, etanol dahil).
- Tonisite ise sadece hücre zarından geçemeyen ve bu nedenle etkin osmotik basınç oluşturan partiküllerin (örn. Na⁺, K⁺, glukoz) konsantrasyonuna bakar.
Klinik Önemi: Bir IV sıvının vücuttaki etkisini tahmin etmek istediğimizde osmolaritesine değil, tonisitesine bakarız. Üre gibi maddeler osmolariteyi artırsa da hücre zarından serbestçe geçebildiği için tonisiteye katkıda bulunmaz ve hücre volümünü değiştirmez.
4. Çözelti Türleri ve Hücre Üzerindeki Etkileri

Çözeltiler, insan plazmasının tonisitesiyle (≈290 mOsm/L) karşılaştırılarak üçe ayrılır:
(Dikkat! Çözeltiler; izotonik, hipotonik, hipertonik diye sınıflanıyor. İzoosmotik, hipoosmotik, hiperosmotik diye değil)
A) İzotonik Çözeltiler (Iso-: eşit)
- Tanım: Plazma ile aynı etkin osmolariteye (tonisiteye) sahip çözeltilerdir.
- Örnekler: %0.9 (İzotonik) Sodyum Klorür (Salin), Lactated Ringer's.
- Hücresel Etkisi: Hücrenin içi ve dışı arasında net bir su hareketi olmaz. Hücre volümü sabit kalır.
- Klinik Kullanım: Damar içi volümü genişletmek için kullanılır. Kan kaybı, dehidratasyon veya cerrahi kayıpların replasmanında birincil tercihtir. Hücre dışı kompartmanda kalır.
B) Hipotonik Çözeltiler (Hypo-: az)
- Tanım: Plazmadan daha düşük etkin osmolariteye (tonisiteye) sahip çözeltilerdir.
- Örnekler: %0.45 Sodyum Klorür (Yarım Salin), %5 Dekstroz (D5W) [Dekstroz başlangıçta izotoniktir ancak vücutta hızla metabolize olur, geriye saf su kalır ve hipotonik etki yaratır].
- Hücresel Etkisi: Dış ortamdaki çözünen madde konsantrasyonu daha az olduğu için, su osmoz yoluyla hücre içine girer. Bu, hücrenin şişmesine (ödem) ve patlamasına (li̇z) neden olabilir.
- Klinik Kullanım: Hücre içi dehidratasyonu (hipernatremi, hiperglisemi) düzeltmek için dikkatle kullanılır. Aşırı ve hızlı kullanımı, hayatı tehdit eden beyin ödemine neden olabilir.
C) Hipertonik Çözeltiler (Hyper-: fazla)
- Tanım: Plazmadan daha yüksek etkin ozmolariteye (tonisiteye) sahip çözeltilerdir.
- Örnekler: %3 Sodyum Klorür, %5 Sodyum Klorür, Mannitol.
- Hücresel Etkisi: Dış ortamdaki çözünen madde konsantrasyonu daha fazla olduğu için, su osmoz yoluyla hücre dışına çıkar. Bu, hücrenin büzüşmesine (krenasyon) neden olur.
- Klinik Kullanım: Şiddetli hiponatremi tedavisinde ve beyin ödemini azaltmak için (örn. mannitol) kullanılır. Aşırı kullanımı, aşırı hücre içi su kaybına ve damar içi volüm yüklenmesine neden olabileceğinden son derece dikkat gerektirir.
Sonuç
Osmos, osmotik basınç ve tonisite kavramları, genel cerrahinin temel taşlarından biridir. Ameliyathane veya yoğun bakımda hangi İV sıvının hangi durumda verileceğine karar verirken, aslında bu fiziksel prensipleri uygularız. Verilen sıvının hücre volümünü ve dolayısıyla damar içi hacmi nasıl etkileyeceğini ön görmemizi sağlarlar. Yanlış tonisitedeki bir sıvı, nörolojik hasar gibi ciddi komplikasyonlara yol açabilir.
Bir sonraki başlığımızda, elektrolitlerin plazma ile interstisyel sıvı arasındaki dağılımını yöneten önemli bir denge olan Gibbs-Donnan Dengesi'ni inceleyeceğiz.
Sıvı Elektrolit Dengesi
- Giriş
- Temel Kavramlar
- Vücut Sıvı Kompartmanları ve Dağılımı
- Sıvı ve Elektrolit Dengesinin Fizyolojik Regülasyonu (ADH, RAAS ve Susama)
- Sıvı ve Elektrolit Denge Bozukluklarının Nedenleri
- Sıvı ve Elektrolit Bozukluklarının Sınıflandırılması
- Sıvı Elektrolit Bozukluklarında Fizik Muayene ve Laboratuvar