Yazan: Prof. Dr. Ömer Rıdvan Tarhan
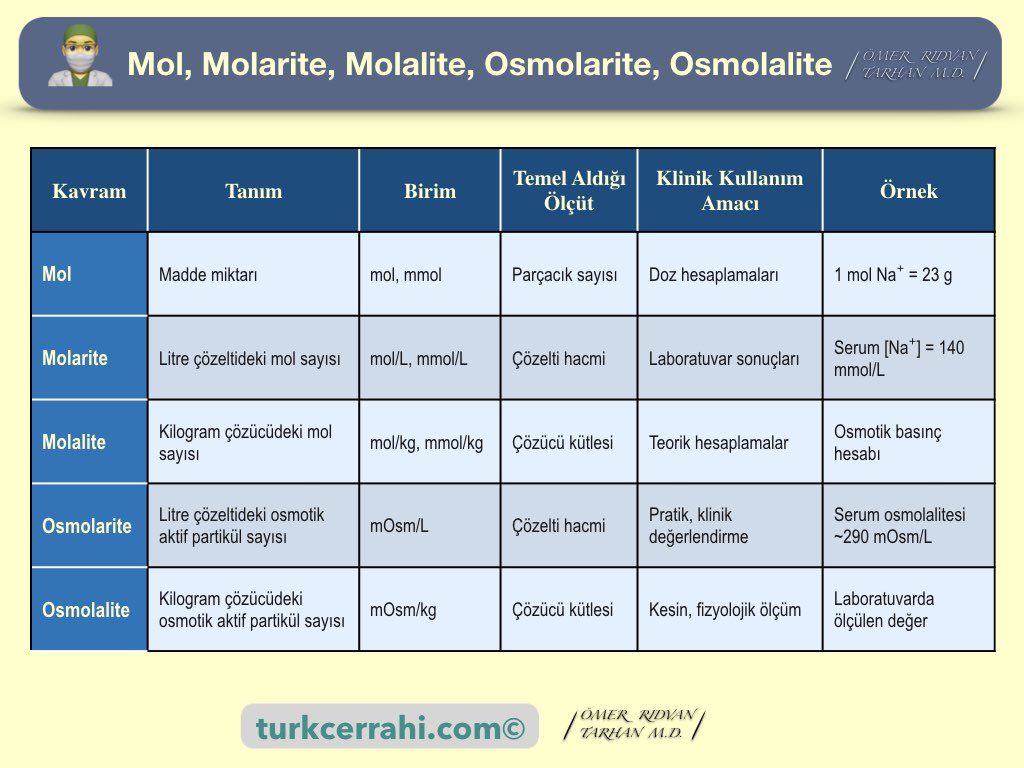
1. Mol: Madde Miktarının Temel Birimi
Basitçe bir mol, ~6.022 × 10²³ adet demektir. Daha bilimsel ifade edersek, Mol, SI sisteminde (uluslararası birim sistemi) madde miktarını ifade eden temel birimidir. 1 mol, Avogadro sayısı kadar (~6.022 × 10²³) temel parçacık (atom, iyon, molekül) içerir.
Kaynaklarda açık açık yazmıyor ama ben size bu sayının nereden geldiği ile ilgili bir sır vereceğim. 6.022 × 10²³ dalton (veya akb (atomik kütle birimi)) 1 gramdır. Proton ve nötronların ağırlığı da hemen hemen 1 daltondur. Sonuç olarak 1 mol proton (ya da nötronun) ağırlığı 1 gramdır. Karbon-12 izotopunda 6 proton, 6 nötron bulunur. Dolayısıyla 1 mol karbon 12 gram çeker 🙂.
Şimdi kaynakların (bana göre kulağı tersten gösteren) tanımını yazalım: Avogadro sayısı (~6.022 × 10²³); 12 gram Karbon-12 izotopunun içinde bulunan karbon atomu sayısıdır (Standardizasyon için karbon-12 izotopunda karar kılınmıştır).
Peki niye karbona iltimas geçilmiş? Çünkü doğada oldukça yaygın bulunan, kütle spektrometresi ile son derece hassas bir şekilde ölçülebilen, organik kimyanın (hayatın) temelini oluşturan bir atomdur.
Örnekler:
- Hidrojen (H) atomunun atom ağırlığı ≈ 1’dir
- 1 mol H atomu = 1 gram’dır
- Oksijen (O) atomunun atom ağırlığı ≈ 16’dır
- 1 mol O atomu = 16 gram’dır
- Su (H₂O) molekülünün molekül ağırlığı = (2×1) + 16= 18 gram/mol dür
- Glukoz (C₆H₁₂O₆) Molekül ağırlığı molekül ağırlığı= 180 gram/mol dür
Atom ağırlıklarının eşit (=) yerine yaklaşık (≈) olarak gösterilmesinin nedeni (ya da periyodik cetvelde küsuratlı olmasının nedeni): Atom ağırlıklarının, atomların doğada bulunan farklı izotoplarının ağırlıklarının ortalaması olmasıdır. Hatırlayalım; doğada atomlar tek tip bulunmaz, farklı izotopları bulunur. Mesela karbonun 3 izotopu bulunur; karbon-12 (%98.93), karbon-13 (%1.07), karbon-14 eser miktarda. Dolayısı ile karbon 12, 13 ve 14 izotoplarının 1 mollerinin ağırlıkları, 12, 13 ve 14 gramdır. Bu yüzden karbonun atom ağırlığı periyodik tabloda 12.011 olarak yazıyor (Not: Atom numarası, bir atomun çekirdeğindeki proton sayısıdır).
Konuyu yeterince dağıttıktan sonra geri dönelim… 😀
Klinik Önemi
Mol, laboratuvar değerlerinde kullandığımız mmol kavramının temelidir. Serum elektrolit düzeyleri mmol cinsinden ifade edilir:
- [Na⁺] = 140 mmol/L (1 litre kanda 140 milimol sodyum iyonu )
- [K⁺] = 4 mmol/L
- Glukoz ≈ 5 mmol/L
2. Molarite (M)
- Tanım: 1 litre çözeltide çözünmüş maddenin mol sayısıdır.
- Formül: Molarite (M) = Çözünenin mol sayısı (mol) / Çözeltinin hacmi (L)
- Birim: mol/L veya mmol/L.
- Klinik Önemi: Laboratuvar ölçümlerinin neredeyse tamamı (Na⁺, K⁺, glukoz, üre) molarite cinsinden ifade edilir. Bu, konsantrasyonu ifade etmenin en yaygın yoludur. Ancak, çözeltinin hacmi sıcaklık ve basınca bağlı değişebildiğinden kesin hesaplamalarda sınırlıdır.
3. Molalite (m)
- Tanım: 1 kilogram çözücüde çözünmüş maddenin mol sayısıdır.
- Formül: Molalite (m) = Çözünenin mol sayısı (mol) / Çözücünün kütlesi (kg)
- Birim: mol/kg veya mmol/kg.
- Klinik Önemi: Molalite, sıcaklık ve basınçtan bağımsızdır çünkü kütle (kg) bu değişkenlerden etkilenmez. Bu nedenle, donma noktası düşmesi veya osmotik basınç gibi koligatif özelliklerin hesaplanmasında molariteye göre daha doğru ve güvenilir bir birimdir. Klinikte osmolarite pratikte daha çok kullanılsa da, teorik altyapısını molalite oluşturur.
4. Osmolarite ve Osmolalite
Tanım
- Osmolarite: 1 L çözeltideki osmotik aktif partikül sayısı (mOsm/L).
- Osmolalite: 1 kg çözücüdeki osmotik aktif partikül sayısı (mOsm/kg).
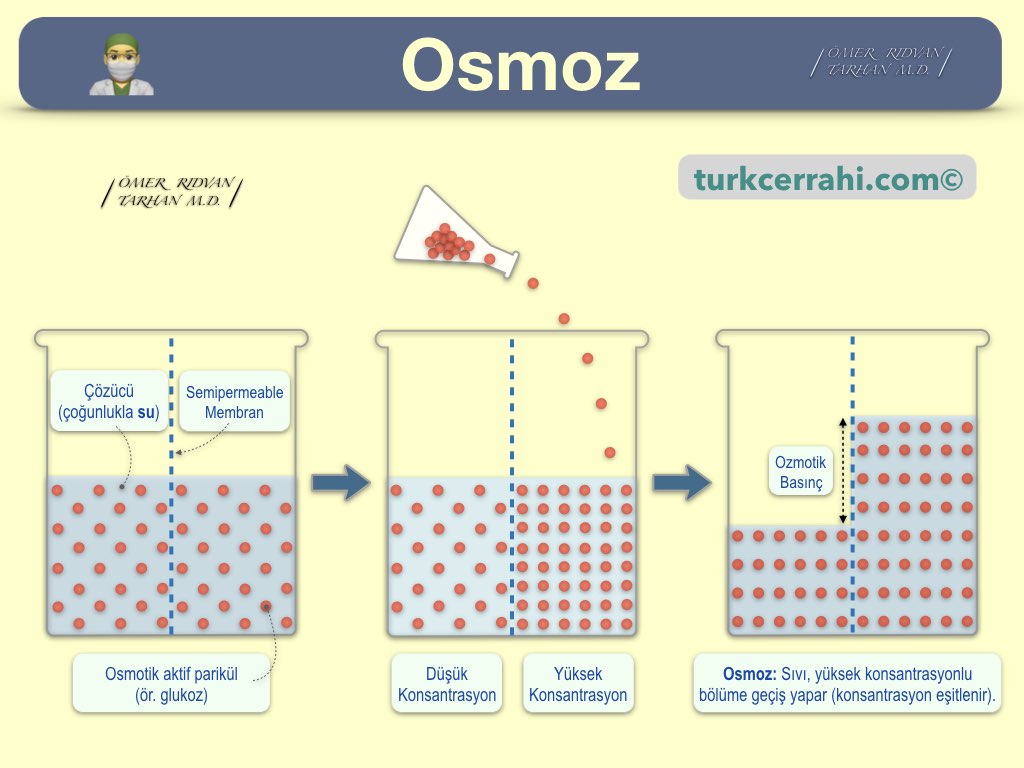
Osmotik Aktif Partikül Nedir?
Çözeltide bağımsız hareket edebilen ve osmotik basınca katkıda bulunan her bir iyon veya moleküldür. Örneğin;
- NaCl → Na⁺ ve Cl⁻ olarak ayrışır → 2 osmotik aktif partikül.
- Glukoz (şeker) → ayrışmaz → 1 osmotik aktif partikül.
- Üre → hücre zarından serbestçe geçebildiği için etkin osmotik basınca katkısı yoktur.
Formül (Yaklaşık Plazma Osmolalitesi):
- Plazma Osmolalitesi (mOsm/kg) ≈ 2[Na⁺] + [Glukoz] / 18 + [BUN] / 2.8
- [Na⁺] → (mmol/L)
- [Glukoz] → (mg/dL)
- [BUN] → (mg/dL)
Klinik Önemi (Neden Bu Kadar Kritik?):
- Sıvı Hareketinin Ana Belirleyicisidir: Su, osmotik basıncın yüksek olduğu (yani osmolaritesi yüksek olan) bölgeye doğru hareket eder. İntravenöz sıvı seçimi (izotonik, hipotonik, hipertonik) tamamen bu prensibe dayanır.
- Hiponatremi ve Hipernatremi Ayırıcı Tanısında Rol Oynar: Ölçülen ve hesaplanan osmolalite arasındaki fark (osmolar gap), metanol, etilen glikol gibi toksinlerin varlığını gösterebilir.
- ADH Salınımının En Güçlü Uyaranıdır: Plazma osmolalitesindeki %1-2'lik bir artış bile ADH salınımını uyararak su tutulumuna neden olur.
5. Özet
Cerrahi hastada sıvı-elektrolit tedavisine yaklaşırken, verilen sıvının osmolaritesi ile hastanın plazma osmolaritesi arasındaki ilişkiyi anlamak esastır. İzotonik bir sıvı (örn. %0.9 NaCl), plazma ile aynı osmolariteye sahip olduğu için hücre dışı kompartmanda kalır. Hipotonik bir sıvı (örn. %5 Dekstroz), plazmadan daha düşük osmolariteye sahiptir ve suyun hücre içine geçişine neden olur. Hipertonik bir sıvı (örn. %3 NaCl) ise suyu hücre dışına çekerek volümü artırır. İşte bu kritik kararların altında yatan temel bilim, mol, molarite ve osmolarite kavramlarıdır. Bir sonraki başlığımız olan osmos ve tonisite, bu kavramların hücresel düzeydeki etkilerini inceleyecektir.
Sıvı Elektrolit Dengesi
- Giriş
- Temel Kavramlar
- Vücut Sıvı Kompartmanları ve Dağılımı
- Sıvı ve Elektrolit Dengesinin Fizyolojik Regülasyonu (ADH, RAAS ve Susama)
- Sıvı ve Elektrolit Denge Bozukluklarının Nedenleri
- Sıvı ve Elektrolit Bozukluklarının Sınıflandırılması
- Sıvı Elektrolit Bozukluklarında Fizik Muayene ve Laboratuvar